研究概要
生物有機化学分野では、優れた特殊機能をもつ分子を設計・創出し、創薬化学・生命科学に貢献することをめざした研究を進めています。有機化学を基盤として、独自のアイデアを盛り込んだ機能性分子を開発し、新たな生命現象の解明、疾病の発症機構の解明や治療などにつなげていきたいと考えています。
1 中分子化合物の活性および物性を制御する新手法
ペプチドや核酸などの中分子化合物は、低分子医薬品では達成が難しい生物活性を設計できることに加え、化学合成できるため製造コストが抑えられるという利点があるため、低分子医薬品や高分子医薬品に次ぐ、新たな創薬モダリティ(方法、手段)として注目されています。ですが、解決すべき大きな課題がいくつか残されています。私たちは、環状から直鎖状への構造変換を用いることで、病変細胞などの特定環境下でのみ活性を示す中分子を開発し、それら課題の克服をめざしています。
関連文献:
• H. Kitagawa, M. Kikuchi, S. Sato, H. Watanabe, N. Umezawa, M. Kato, Y. Hisamatsu, T. Umehara, T. Higuchi, "Structure-based identification of potent lysine-specific demethylase 1 inhibitor peptides and temporary cyclization to enhance proteolytic stability and cell growth-inhibitory activity." J. Med. Chem., 64, 3707-3719, 2021.
• Y. Amano, N. Umezawa, S. Sato, H. Watanabe, T. Umehara, T. Higuchi, "Activation of lysine-specific demethylase 1 inhibitor peptide by redox-controlled cleavage of a traceless linker."
Bioorg. Med. Chem., 25, 1227-1234, 2017.
• N. Umezawa, Y. Noro, K. Ukai, N. Kato, T. Higuchi, "Photocontrol of peptide function: Backbone cyclization strategy with photocleavable amino acid." ChemBioChem, 12, 1694-1698, 2011.

関連文献:
• H. Kitagawa, M. Kikuchi, S. Sato, H. Watanabe, N. Umezawa, M. Kato, Y. Hisamatsu, T. Umehara, T. Higuchi, "Structure-based identification of potent lysine-specific demethylase 1 inhibitor peptides and temporary cyclization to enhance proteolytic stability and cell growth-inhibitory activity." J. Med. Chem., 64, 3707-3719, 2021.
• Y. Amano, N. Umezawa, S. Sato, H. Watanabe, T. Umehara, T. Higuchi, "Activation of lysine-specific demethylase 1 inhibitor peptide by redox-controlled cleavage of a traceless linker."
Bioorg. Med. Chem., 25, 1227-1234, 2017.
• N. Umezawa, Y. Noro, K. Ukai, N. Kato, T. Higuchi, "Photocontrol of peptide function: Backbone cyclization strategy with photocleavable amino acid." ChemBioChem, 12, 1694-1698, 2011.
私たちが提案する一時的環状化を用いた活性・物性制御法の概略
2 立体構造安定化を基盤とする機能性ペプチド誘導体の開発
ペプチドはフレキシブルな分子で、安定な立体構造を形成しないため、タンパク質のような強い活性は通常示しません。私たちは、機能をもつペプチドの立体構造を安定化することで、活性の向上をめざす研究を進めています。開発する分子は、高い活性に加えて、中分子の欠点の一つである生体内安定性が低いという問題点の克服も期待できます。
また、最近は、可逆的共有結合形成反応を用いて、高い活性をもつペプチドをみつける手法の開発に取り組んでいます。機能をもつ立体構造を安定化することで強い活性をもつペプチドを生み出すことができますが、どのような化学修飾が適切かを予測することが難しく、多くの候補化合物を合成して評価する必要があります。この過程を効率化できる新手法を開発すべく、研究に取り組んでいます。
関連文献:
• Y. Imamura, N. Umezawa, S. Osawa, N. Shimada, T. Higo, S. Yokoshima, T. Fukuyama, T. Iwatsubo, N. Kato, T. Tomita, T. Higuchi, "Effect of helical conformation and side-chain structure on g-secretase inhibition by b-peptide foldamers: Insight into substrate recognition. "
J. Med. Chem., 56, 1443-1454, 2013.
• Y. Imamura, N. Watanabe, N. Umezawa, T. Iwatsubo, N. Kato, T. Tomita, T. Higuchi, "Inhibition of g-secretase activity by helical b-peptide foldamers." J. Am. Chem. Soc., 131, 7353-7359, 2009.
![]()
また、最近は、可逆的共有結合形成反応を用いて、高い活性をもつペプチドをみつける手法の開発に取り組んでいます。機能をもつ立体構造を安定化することで強い活性をもつペプチドを生み出すことができますが、どのような化学修飾が適切かを予測することが難しく、多くの候補化合物を合成して評価する必要があります。この過程を効率化できる新手法を開発すべく、研究に取り組んでいます。
関連文献:
• Y. Imamura, N. Umezawa, S. Osawa, N. Shimada, T. Higo, S. Yokoshima, T. Fukuyama, T. Iwatsubo, N. Kato, T. Tomita, T. Higuchi, "Effect of helical conformation and side-chain structure on g-secretase inhibition by b-peptide foldamers: Insight into substrate recognition. "
J. Med. Chem., 56, 1443-1454, 2013.
• Y. Imamura, N. Watanabe, N. Umezawa, T. Iwatsubo, N. Kato, T. Tomita, T. Higuchi, "Inhibition of g-secretase activity by helical b-peptide foldamers." J. Am. Chem. Soc., 131, 7353-7359, 2009.
3 機能性ポリアミン誘導体の設計・合成
私たちは、ポリアミン(複数のアミノ基をもつ有機分子)構造をもつ有機小分子に興味を持って研究を進めています。生体内には、スペルミンやスペルミジンなどのポリアミンが存在し、細胞増殖に必須であることが知られています。私たちは、ポリアミン誘導体を効率的に合成できる固相合成法の開発を進め、酵素阻害剤として機能するものなど、さまざまな機能をもつポリアミン誘導体を開発しています。特に、核酸と結合し興味深い機能を発揮するポリアミン誘導体を開発しており、核酸を標的とした医薬への展開をめざして研究を進めています。
関連文献:
• N. Umezawa, K. Tsuji, S. Sato, M. Kikuchi, H. Watanabe, Y. Horai, M. Yamaguchi, Y. Hisamatsu, T. Umehara, T. Higuchi, "Inhibition of FAD-dependent lysine-specific demethylases by chiral polyamine analogues." RSC Adv., 8, 36895-36902, 2018.
• M. A. Gulshan, K. Tsuji, S. Matsumura, T. Higuchi, N. Umezawa, Y. Ikawa, "Distinct modulation of group I ribozyme activity among stereoisomers of a synthetic pentamine with structural constraints." Biochem. Biophys. Res. Commun., 504, 698-703, 2018.
• T. Nishio, Y. Yoshikawa, W. Fukuda, N. Umezawa, T. Higuchi, S. Fujiwara, T. Imanaka, K. Yoshikawa, "Branched-chain polyamine found in hyperthermophiles induces unique temperature-dependent structural changes in genome-size DNA." ChemPhysChem, 19, 1-7, 2018.
• A. Muramatsu, Y. Shimizu, Y. Yoshikawa, W. Fukuda, N. Umezawa, Y. Horai, T. Higuchi, S. Fujiwara, T. Imanaka, K. Yoshikawa, "Naturally occurring branched-chain polyamines induce a crosslinked meshwork structure in a giant DNA." J. Chem. Phys., 145, 235103, 2016.
• N. Umezawa, Y. Horai, Y. Imamura, M. Kawakubo, M. Nakahira, N. Kato, A. Muramatsu, Y. Yoshikawa, K. Yoshikawa, T. Higuchi, "Structurally diverse polyamines: Solid-phase synthesis and interaction with DNA." ChemBioChem, 16, 1811-1819, 2015.
• Y. Yoshikawa, N. Umezawa, Y. Imamura, T. Kanbe, N. Kato, K. Yoshikawa, T. Imanaka, T. Higuchi, "Effective chiral discrimination of tetravalent polyamines on single-DNA compaction. "
Angew. Chem. Int. Ed., 52, 3712-3716, 2013.

関連文献:
• N. Umezawa, K. Tsuji, S. Sato, M. Kikuchi, H. Watanabe, Y. Horai, M. Yamaguchi, Y. Hisamatsu, T. Umehara, T. Higuchi, "Inhibition of FAD-dependent lysine-specific demethylases by chiral polyamine analogues." RSC Adv., 8, 36895-36902, 2018.
• M. A. Gulshan, K. Tsuji, S. Matsumura, T. Higuchi, N. Umezawa, Y. Ikawa, "Distinct modulation of group I ribozyme activity among stereoisomers of a synthetic pentamine with structural constraints." Biochem. Biophys. Res. Commun., 504, 698-703, 2018.
• T. Nishio, Y. Yoshikawa, W. Fukuda, N. Umezawa, T. Higuchi, S. Fujiwara, T. Imanaka, K. Yoshikawa, "Branched-chain polyamine found in hyperthermophiles induces unique temperature-dependent structural changes in genome-size DNA." ChemPhysChem, 19, 1-7, 2018.
• A. Muramatsu, Y. Shimizu, Y. Yoshikawa, W. Fukuda, N. Umezawa, Y. Horai, T. Higuchi, S. Fujiwara, T. Imanaka, K. Yoshikawa, "Naturally occurring branched-chain polyamines induce a crosslinked meshwork structure in a giant DNA." J. Chem. Phys., 145, 235103, 2016.
• N. Umezawa, Y. Horai, Y. Imamura, M. Kawakubo, M. Nakahira, N. Kato, A. Muramatsu, Y. Yoshikawa, K. Yoshikawa, T. Higuchi, "Structurally diverse polyamines: Solid-phase synthesis and interaction with DNA." ChemBioChem, 16, 1811-1819, 2015.
• Y. Yoshikawa, N. Umezawa, Y. Imamura, T. Kanbe, N. Kato, K. Yoshikawa, T. Imanaka, T. Higuchi, "Effective chiral discrimination of tetravalent polyamines on single-DNA compaction. "
Angew. Chem. Int. Ed., 52, 3712-3716, 2013.
生体内に存在するポリアミンと私たちが固相合成したポリアミンの例
4 生体分子を水中で精密認識する人工レセプターの開発(生命現象の解明や制御に役立つツールとして)
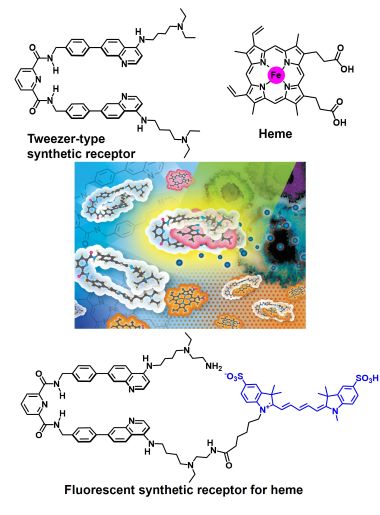
私たちは、分子間相互作用を利用し複数の分子が集まることで優れた機能を発揮する超分子の開発研究を行っています。生体内で重要な役割を担う分子を水中で高選択的に認識する人工レセプターを設計・合成できれば、生命現象の解明や制御につながる新たなツールとして利用できます。しかしながら、タンパク質がもつ標的分子に対する精密な分子認識能を水中で合成分子を用いて実現することは容易ではありません。私たちは、鉄-ポルフィリン錯体であるヘムに着目し、水中でヘムを認識する人工レセプターの開発研究を通してこの課題にチャレンジしています。また、ポルフィリンに対する人工レセプターの結合親和性を利用し、光増感剤との複合体形成を鍵とする光線力学療法への応用研究にも取り組んでいます。
関連文献
• Y. Hisamatsu, K. Otani, H. Takase, N. Umezawa, T. Higuchi, "Fluorescence response and self-assembly of a tweezer-type synthetic receptor triggered by complexation with heme and its catabolites", Chem. Eur. J., 2021, 27, 6489–6499.
• Y. Hisamatsu, N. Umezawa, H. Yagi, K. Kato, T. Higuchi, "Design and synthesis of a 4-aminoquinoline-based molecular tweezer that recognizes protoporphyrin IX and iron(III) protoporphyrin IX and its application as a supramolecular photosensitizer", Chem. Sci., 2018, 9, 7455-7467.
関連文献
• Y. Hisamatsu, K. Otani, H. Takase, N. Umezawa, T. Higuchi, "Fluorescence response and self-assembly of a tweezer-type synthetic receptor triggered by complexation with heme and its catabolites", Chem. Eur. J., 2021, 27, 6489–6499.
• Y. Hisamatsu, N. Umezawa, H. Yagi, K. Kato, T. Higuchi, "Design and synthesis of a 4-aminoquinoline-based molecular tweezer that recognizes protoporphyrin IX and iron(III) protoporphyrin IX and its application as a supramolecular photosensitizer", Chem. Sci., 2018, 9, 7455-7467.

私たちが開発した人工ヘムレセプターの例
5 水中で形成される多様な形状やサイズのナノ構造体の創製と機能創出
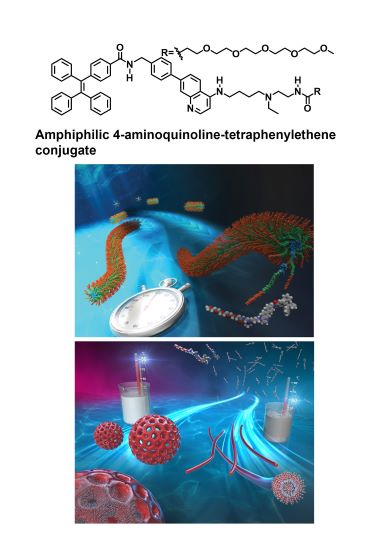
DNAの二重らせん構造、細胞膜を形成する脂質二重層やタンパク質集合体は、自然界に存在する美しい分子集合体です。私たちは、独自に設計・合成した両親媒性分子が水中で自発的に集合することで形成する秩序だった美しい構造体の構築と機能創出に関する研究を行っています。特に、分子の自己集合過程の理解と制御に興味をもち、一つの分子から多様な形状やサイズの構造体を構築する手法の開拓に取り組んでいます。
関連文献
• Y. Hisamatsu, G. Toriyama, K. Yamamoto, H. Takase, T. Higuchi, N. Umezawa, "Temperature control of the self-assembly process of 4-aminoquinoline amphiphile: selective construction of perforated vesicles and nanofibers, and structural restoration capability", Chem. Eur. J., 2024. 30(36), e202400134.
• Y. Hisamatsu, F. Cheng, K. Yamamoto, H. Takase, N. Umezawa, T. Higuchi, "Control of the stepwise self-assembly process of a pH-responsive amphiphilic 4-aminoquinoline-tetraphenylethene conjugate", Nanoscale, 2023, 15, 3177-3187.
関連文献
• Y. Hisamatsu, G. Toriyama, K. Yamamoto, H. Takase, T. Higuchi, N. Umezawa, "Temperature control of the self-assembly process of 4-aminoquinoline amphiphile: selective construction of perforated vesicles and nanofibers, and structural restoration capability", Chem. Eur. J., 2024. 30(36), e202400134.
• Y. Hisamatsu, F. Cheng, K. Yamamoto, H. Takase, N. Umezawa, T. Higuchi, "Control of the stepwise self-assembly process of a pH-responsive amphiphilic 4-aminoquinoline-tetraphenylethene conjugate", Nanoscale, 2023, 15, 3177-3187.

ナノ構造体を構築するために私たちが開発した分子の例